סרטן עצמות
סברינה קמפה היא כותבת עצמאית בצוות הרפואי של היא למדה ביולוגיה, והתמחתה בביולוגיה מולקולרית, גנטיקה אנושית ופרמקולוגיה. לאחר הכשרתה כעורך רפואי בהוצאה מומחית ידועה, הייתה אחראית על כתבי עת מומחים ומגזין מטופלים. כעת היא כותבת מאמרים בנושאים רפואיים ומדעיים למומחים ולדיוטים ועורכת מאמרים מדעיים של רופאים.
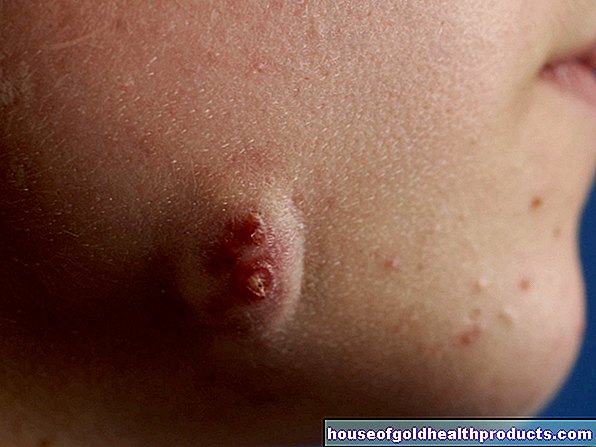
עוד על המומחים של כל תוכן נבדק על ידי עיתונאים רפואיים.סרטן עצמות (אוסטאוסרקומה) היא מחלה נדירה שיש לה סוגים שונים. גידול העצם הממאיר הנפוץ ביותר הוא אוסטאוסרקומה. אם מתגלה מוקדם, ניתן לטפל ברוב הגידולים הללו. קרא עוד על הנושא כאן: אילו תסמינים גורמים לסרטן העצמות או לאוסטאוסרקומה? כיצד נראים אבחונים וטיפולים? האם סרטן העצמות קטלני? מה תוחלת החיים?
קודי ICD למחלה זו: קודי ICD הם קודים מוכרים בינלאומיים לאבחונים רפואיים. ניתן למצוא אותם, למשל, במכתבי רופא או בתעודות של כושר עבודה. C41C40

סקירה קצרה
- מהי אוסטאוסרקומה? הצורה הנפוצה ביותר של סרטן העצמות. צורות עיקריות אחרות הן chondrosarcoma ו- Ewing sarcoma.
- סיבות: לא מובן לגמרי; גורמים גנטיים, צמיחת עצם מהירה בגיל צעיר, מחלות עצמות כרוניות וטיפול קרינתי קודם כל יכולים לשחק תפקיד.
- תסמינים: כאבים ונפיחות באזור הגידול, ניידות מוגבלת (אם המפרקים מושפעים), עצמות שבירות, בשלבים מאוחרים יותר גם חום, ירידה במשקל, ביצועים ירודים או עייפות.
- בדיקות: צילומי רנטגן, טומוגרפיה ממוחשבת, הדמיית תהודה מגנטית, סנטיגרפיה של עצמות או טומוגרפיה של פליטת פוזיטרונים (PET), ניתוח דגימות רקמות (ביופסיה), בדיקות דם
- טיפול: ניתוח, כימותרפיה, הקרנות וטיפול תומך (אמצעים נגד סימפטומים ותופעות לוואי של טיפול).
- תוחלת חיים: ללא טיפול, סרטן העצמות הוא קטלני. חופש ארוך טווח מגידולים אפשרי בעזרת טיפול. יישובי גידולים (גרורות) מחמירים את הפרוגנוזה.
סרטן עצמות - אוסטאוסרקומה: תסמינים
התסמינים הראשונים של סרטן העצם הם בדרך כלל כאבים באזור העצם הפגועה. זה חל על אוסטאוסרקומה כמו גם על צורות אחרות של סרטן עצם. הכאב יכול להיות לא יציב ולהחמיר כאשר האדם מפעיל לחץ על העצם.
עם הזמן גידול העצם הגדל גורם לנפיחות גלויה ו / או מוחשית. האזור הנפוח יכול להיות פחות או יותר כואב. הוא חם למגע והעור באזור זה עשוי להיות בצבע אדום או אפרפר.
תסמינים אפשריים אחרים של אוסטאוסרקומה או סרטן עצם הם ניידות מוגבלת במפרק אם הגידול והנפיחות שנוצרו נמצאים בקרבתו.
כאבי העצמות בילדים ומתבגרים מתפרשים לעתים קרובות ככאבי גדילה. הנפיחות באזור הגידול נערכת לעתים קרובות גם באופן שגוי כתוצאה מפציעה ספורט או מחלה ראומטית.
אופיינית לאוסטיאוסרקומה היא השבריריות המוגברת של העצם המושפעת: באוסטיאוסרקומה התאים היוצרים בדרך כלל את העצם מתנוונים. הם מתחילים להתחלק ולצמוח ללא שליטה. זה יוצר רקמת עצם בוגרת וכמעט לא יציבה (אוסטיאואיד).
גידול אוסטאוגני כזה מתפתח בעיקר בעצמות הצינוריות הארוכות בזרועות וברגליים, לרוב ליד מפרקי הכתף והברך. במקומות אלה, העצם הבלתי יציבה אינה עמידה במיוחד ולכן נשברת בקלות. לאחר מכן הרופאים מדברים על שבר פתולוגי. זהו הסימן הראשון לאוסטאוסרקומה בכל חולה 20.
גרורות בסרטן העצמות
אם סרטן העצמות כבר התפשט, כלומר יצר יישובי בת (גרורות), ניתן להוסיף סימפטומים של סרטן העצם לעיל, חום, תחושת מחלה כללית, ירידה במשקל, ביצועים ירודים ועייפות.
אם מתפתחים קני גידול חדשים באותה עצם כמו הגידול המקורי והראשוני או בצד הנגדי של מפרק, אנו מדברים על גרורות לדלג.
סרטן עצמות - אוסטאוסרקומה: תוחלת חיים
בין אם מדובר באוסטאוסרקומה או בצורת סרטן עצמות אחרת, גידול עצם ממאיר הוא תמיד מחלה מסוכנת ממנה נפגעים מתים תוך שנים ספורות ללא טיפול יעיל.
אך גם עם הטיפול, הדברים הבאים חלים על סרטן העצמות: המחלה אינה ניתנת לריפוי במובן האמיתי של המילה. עם זאת, ניתן להשיג חופש ארוך טווח מגידולים. כלומר: הטיפול הנכון יכול לדחוף את סרטן העצמות לאחור. עם זאת, החולים צריכים לצפות להישנות ולהשפעות ארוכות טווח במהלך חייהם.
תוחלת החיים של סרטן העצם: לגרורות יש השפעה
במקרים בודדים, תוחלת החיים של סרטן העצם מושפעת באופן משמעותי מהמרחק שהגידול התפשט כשהתגלה. לרוע המזל, בשל הסימפטומים הלא -ספציפיים, סרטן העצמות בדרך כלל מתגלה רק מאוחר - כלומר, כאשר הוא כבר התפשט דרך הדם וכלי הלימפה בגוף ונוצרו תת -מחלקות (גרורות).
לעתים קרובות מאוד מדובר בגרורות ריאה. בזמן האבחון גרורות באזורים אחרים של השלד (גרורות בעצמות) פחות שכיחות. ככלל, תוחלת החיים נמוכה יותר בקרב חולי סרטן עצם עם גרורות בעצמות מאשר בחולים עם גרורות ריאה.
בנוסף, הניסיון מראה שלרוב הנפגעים כבר יש את הגרורות הקטנות ביותר, מה שנקרא מיקרומסטסטות, בזמן האבחון. עם זאת, לא ניתן להראות את אלה בשיטות הדמיה של היום, אלא רק מאוחר יותר כשהן קצת יותר גדולות.
תוחלת החיים של סרטן העצם: גורמי השפעה אחרים
עד כמה סיכויי ההחלמה ותוחלת החיים גבוהים לסרטן העצמות תלויים לא רק בהתפשטות הגידול, אלא גם בגורמי סיכון ופרוגנוזה אחרים. לדוגמה, הוא גם חיוני:
- עד כמה סרטן העצמות ממאיר? (מידת הממאירות תלויה באיזו מידה התאים הסרטניים מתחלקים וגדלים, דבר שניתן לקבוע באמצעות דגימת רקמה במעבדה)
- היכן בגוף בדיוק נמצא הגידול וכמה הוא גדול?
- האם הגידול וכל גרורות ניתנות לביצוע? האם ניתן להסירם לגמרי או רק באופן חלקי?
- האם טיפולים (כימותרפיה ו / או הקרנות) המשמשים בנוסף לניתוח פועלים בהצלחה?
לנקודה השלישית - יכולת הפעולה של הגידול וכל גרורות שעשויות להיות קיימות - יש השפעה חזקה מאוד על סיכויי ההחלמה בסרטן העצם: לדוגמה, אם גידול העצם נמצא בגזע, הפרוגנוזה בדרך כלל פחות נוחה מאשר במקרה של גידול בעצמות הנגיש יותר בידיים או ברגליים. בדרך כלל גם קשה להגיע לגרורות בגולגולת, בעמוד השדרה או בעצמות כלוב הצלעות. ייתכן שלא תוכל להיות מנותח.
פרוגנוזה באוסטאוסרקומה
הצורה הנפוצה ביותר של אוסטאוסרקומה היא האוסטאוסרקומה המרכזית הקלאסית, שהיא מאוד ממאירה (מאוד ממאירה). הודות להתקדמות הרפואית הגדולה בעשורים האחרונים, סיכויי ההישרדות של הנפגעים שופרו באופן משמעותי: אם האוסטאוסרקומה המרכזית הקלאסית מטופלת בניתוח או בכימותרפיה, 50 עד 70 אחוז מהחולים עדיין חיים חמש שנים לאחר האבחון (5 שנים שיעור הישרדות).
צורות אוסטאוסרקומה שהן פחות ממאירות הן בעלות פרוגנוזה נוחה יותר. אבל צורות כאלה נדירות.
שיעורי ההישרדות הם סקרים סטטיסטיים ולכן הם רק קווים מנחים. כיצד למעשה נראים סיכויי ההישרדות של כל מטופל בנפרד.
פרוגנוזה להישנות (הישנות)
אם האוסטיאוסרקומה חוזרת לאחר סיום הטיפול, היא די שלילית למרות כל המאמצים. זה תלוי אם ההישנות ניתנת לניתוח, כמה מוקדם לאחר הסרטן הראשון היא מתרחשת, כמה גרורות קיימות והיכן הן נמצאות.
אוסטאוסרקומה וצורות אחרות של סרטן העצם: תדירות
הסוגים העיקריים של סרטן העצמות הם אוסטאוסרקומה, כונדרוסרקומה וסרקומות יואינג.
אוסטאוסרקומה
האוסטאוסרקומה מתחילה מתאים היוצרים את חומר העצם הבסיסי (מטריצת העצם). זהו הסוג השכיח ביותר של סרטן העצמות בסביבות 40 אחוזים. שניים עד שלושה מתוך מיליון אנשים מקבלים את זה מדי שנה. המחלה מופיעה בעיקר בקרב מתבגרים וצעירים (העשור השני לחיים). המין הגברי מושפע לעתים קרובות יותר מהנקבה.
כונדרוסרקומה
עם נתח של כ -20 אחוזים, כונדרוסרקומה היא הסוג השני בשכיחותו של סרטן העצמות. זה בדרך כלל מתרחש בין הגילאים 50 עד 70, קצת יותר בתדירות אצל גברים מאשר אצל נשים.
הכונדרוסרקומה מתפתחת מרקמת סחוס עובריים או בוגרים. תוכל ללמוד עוד על צורה זו של סרטן עצם במאמר עצם סרטן - כונדרוסרקומה.
הסרקומות של יואינג
סרקומות יואינג נדירות בהרבה מאוסטיאו וכונדרוסרקומות. הם מהווים כשמונה אחוזים מכלל מחלות סרטן העצם.
תסמונות יואינג מתפתחות באופן עדיף, אך לא בלעדי, ברקמת העצם. לעתים רחוקות מאוד הם נוצרים ברקמות רכות (רקמת חיבור, שומן או שריר או רקמות של עצבים היקפיים) - עם או בלי מעורבות של רקמת עצם.
אתה יכול לקרוא עוד על סוגים אלה של סרטן עצם במאמר Bone Cancer - Sarcomas של יואינג.
סרטן העצמות: שלבים
הטיפול בסרטן העצמות (אוסטאוסרקומה וצורות אחרות) תלוי במידה רבה בחומרת המחלה. הגורמים המכריעים הם התפשטות הגידול (על פי מערכת TNM) וסטיית הרקמה הסרטנית מרקמה רגילה (דירוג).
סיווג TNM
סיווג TNM הוא מערכת בשימוש בינלאומי לאפיון גידול בכל הנוגע להתפשטותו. גודל הגידול (T) כמו גם נוכחות גרורות של בלוטות הלימפה (N) וגרורות רחוקות יותר (M) רלוונטיות. עבור גידול עצם ממאיר, סיווג TNM הוא כדלקמן:
- T = גודל הגידול: הסקאלה נעה בין TX (לא ניתן להעריך גידול ראשוני) ו- T0 (ללא עדות לגידול ראשוני) דרך T1 (גודל של 8 ס"מ לכל היותר) ו- T2 (גידול גדול מ -8 ס"מ) ל- T3 ( התפשטות בלתי רציפה בגידול הראשוני) עצמות = דילוג על גרורות)
- N = גרורות בבלוטות הלימפה (= Nodi lymphatici): אם אין בלוטות לימפה מקומיות או שכנות מושפעות מסרטן, ניתן הקיצור "N0". לעומת זאת, "N1" מייצג נוכחות של גרורות בלוטות לימפה אזוריות. "NX" פירושו שלא ניתן להעריך את בלוטות הלימפה האזוריות.
- M = גרורות רחוקות: היעדר גרורות רחוקות מסומן ב- "M0", נוכחותן עם M1. M1a מייצג גרורות ריאה ו- M1b גרורות רחוקות אחרות. אם לא ניתן לבצע הערכה לגבי גרורות רחוקות, "MX" מוצג.
תִשׁבּוּץ
הדירוג ההיסטופתולוגי מציין כמה תאי הגידול כבר השתנו פתולוגית. לשם כך, מידת ההתמיינות של הרקמה נבדקת מתחת למיקרוסקופ: ככל שתא גידול פחות מתבדל, הוא פחות דומה לתא רגיל - וככל שהוא ממאיר יותר. בסך הכל יש את הציונים הבאים:
- G1 = תאים סרטניים מובחנים היטב (פחות ממאירים)
- G2 = תאים סרטניים מובחנים בינוני
- G3 = תאים סרטניים מובחנים בצורה גרועה
- G4 = תאים סרטניים לא מובחנים (ממאירים מאוד)
- GX = לא ניתן להעריך את מידת הבידול
לדוגמה, סרקומה של Ewing של העצם מסווגת תמיד כ- G4.
שלבי סרטן העצמות
הבימוי מבוסס ברובו על סיווג TNM. בנוסף, נלקחת בחשבון הממאירות (הדירוג) של הגידול. בהתאם לכך, מבדילים בין ארבעה שלבים של סרטן העצם (עם חלוקות משנה נוספות). ככל שהשלב גבוה יותר, כך המחלה מתקדמת יותר.
שלב סרטן העצמות I:
התאים של גידול העצם הממאיר הם ממאירים קלות (G1–2). הסרטן עדיין לא התפשט לבלוטות לימפה או לאיברים אחרים (N0, M0). בהתאם לגודל הגידול, שלב זה הראשון של הסרטן מחולק עוד יותר:
- שלב IA: גודל הגידול עד 8 ס"מ (T1).
- שלב IB: גודל הגידול כבר יותר מ- 8 ס"מ (T2).
שלב II של סרטן העצמות:
בשלב זה תאי הגידול ממאירים ביותר (G3–4). עם זאת, עדיין אין גרורות, לא בבלוטות הלימפה השכנות (N0) ולא באזורים אחרים של הגוף (M0). החלוקה הנוספת מבוססת גם על גודל הגידול:
- שלב IIA: גודל הגידול אינו עולה על 8 ס"מ (T1).
- שלב IIB: הגידול כבר גדל ליותר מ 8 ס"מ (T2).
שלב III של סרטן העצמות:
תאי גידול ממאירים בדרגה נמוכה ודרגה גבוהה עשויים להיות קיימים בשלב סרטן זה (כל G). כל גודל גידול אפשרי גם הוא (כל T). עדיין אין גרורות (N0, M0).
שלב IV של סרטן העצמות:
כמו בשלב III, כל דרגה של ממאירות (כל G) וכל גודל גידול (כל T) אפשריות. באשר להימצאות גרורות, נבדלת:
- שלב רביעי: בלוטות הלימפה עשויות להיות מעורבות ובין אם לאו (כל N). יש גרורות מחוץ לריאות (M1b).
- שלב IVA: אין בלוטות לימפה סרטניות (N0), אך יש גרורות בריאות (M1a).
- שלב IVB: בלוטות הלימפה ליד הגידול מושפעות (N1). ישנן גם גרורות בריאות ו / או איברים אחרים (כל M).
סרטן עצמות: בדיקות ואבחון
לקיחת היסטוריה רפואית (היסטוריה רפואית) ובדיקה גופנית כללית הם הצעדים הראשונים של הרופא אם יש לך או לילדך תסמינים בלתי מוסברים כגון כאבי עצמות.
אם הרופא רואה בסימפטומים סימנים אפשריים לסרטן העצם, הם מופנים למרכז גידולים או למרפאה לאונקולוגיה / המטולוגיה ילדים. נערכות שם בדיקות שונות להבהרת החשד לסרטן העצמות - מהן תלויות בחלקן במקרה הפרט. הבדיקות שהוזכרו יכולות לסייע גם בבדיקת הצלחת הטיפול במהלך הטיפול המתמשך בסרטן.
בדיקות מעבדה
אין תכונות ספציפיות בדם שניתן למצוא רק בסרטן העצמות (כלומר אין סמני גידול). עם זאת, כמה חריגות יכולות לתת לרופאים רמזים ראשוניים.
לדוגמה, לחלק מחולי סרטן העצמות יש רמות גבוהות של פוספטאז אלקליין ולקטט דהידרוגנאז (LDH) בסרום הדם. ערכי האנזים עוזרים גם לניטור הצלחת הטיפול: הם יורדים במהלך כימותרפיה. אם הם יעלו שוב לאחר מכן, הדבר עשוי לאותת שהסרטן מתקדם.
נהלי הדמיה
שיטות הדמיה שונות תומכות באבחון כמו גם בטיפול ובמעקב אחר סרטן העצמות.
צילומי רנטגן, למשל, חשובים מאוד: כאשר "צילומי רנטגן", גידולי עצם מראים דפוסים אופייניים בעצם. ניתן להשתמש בצילום רנטגן גם כדי להעריך האם עצמות ארוכות בזרועות וברגליים חשופות יותר לשברים כתוצאה מסרטן. ניתן לזהות גרורות ריאה באמצעות צילום חזה (צילום חזה).
הדמיית תהודה מגנטית (MRT או הדמיית תהודה מגנטית) וטומוגרפיה ממוחשבת (CT) יוצרים תמונות חתך מפורטות של הגוף. המטרה העיקרית של ה- MRI היא לקבוע את המיקום והגודל המדויק של הגידול, כמו גם את תיחומו מהמבנים הסובבים (כגון שרירים, גידים). ידע זה מסייע בעת לקיחת דגימת רקמה (ביופסיה) או תכנון ניתוח.
ניתן להשתמש ב- CT גם לביופסיה. הוא גם מסייע בחיפוש אחר גרורות בחזה ובבטן ובהערכת הסיכון המוגבר לשבירה כתוצאה מסרטן העצם (עמוד השדרה והאגן נמצאים בסיכון גבוה במיוחד כאן).
באמצעות סקינטיגרפיה שלד של כל הגוף (SSC) - גרסה של סקינטיגרפיה של עצם - הרופא יכול לבדוק עד כמה הפעילות המטבולית גבוהה ברקמת העצם. ייתכנו תאי גידול באזורים פעילים מאוד מטבולית. לדוגמה, ניתן לקבוע את היקף הגידול לפני הניתוח ולזהות גרורות בעצמות.
במקרים מסוימים, טומוגרפיה של פליטת פוזיטרונים (PET) משמשת גם לסרטן העצמות. זה יכול גם להדגים את הפעילות המטבולית שהשתנתה ברקמת הגידול. בשילוב עם טומוגרפיה ממוחשבת (PET / CT) ניתן להציג את המבנה האנטומי של הרקמה המדוברת בדיוק באותו הזמן.
בדיקת רקמת הגידול
אם ההדמיה מאשרת את החשד לסרטן העצם, יש לקחת דגימה מהרקמה החשודה (ביופסיה) לצורך האבחנה הסופית. הוא נבדק בקפידה במעבדה בשיטות שונות על מנת לזהות בבירור את הסרטן וכדי לתכנן את הטיפול הנכון.
ניתוח דגימת רקמות יכול להיות שימושי גם במהלך טיפול כימותרפי בסרטן העצמות, למשל כדי לבדוק את הצלחת הטיפול. אם הכימותרפיה הצליחה להרוס יותר מ -90 אחוזים מהתאים המנווונים, הגידול הגיב היטב לטיפול. אם יש פחות הסיכון שהסרטן יחזור עולה.
יש לתכנן בקפידה ביופסיה של גידול בעצמות כדי לא לסכן או לסבך ניתוח לאחר מכן. לכן הביופסיה צריכה להתבצע רק על ידי צוות מומחים המתמחה בסרטן עצם.
הגידול שהוסר בניתוח הסרטן נבדק גם הוא במעבדה. בטח יש רקמה בריאה מסביב לקצה שלה. רק אז אתה יכול להיות בטוח שכל הגידול הממאיר הוסר למעשה.
בדיקת מח העצם ומי העצב
בסרקומה של יואינג יש לבדוק את מח העצם ולפעמים גם את נוזל העצב (נוזל מוחי שדרתי) לאשר סרטן.
אתה יכול לקרוא עוד על זה תחת סרטן העצמות - סרקומות של יואינג.
סרטן עצמות: טיפול
סרטן עצמות מכל סוג שהוא (אוסטאוסרקומה, כונדרוסרקומה וכו ') צריך להיות מטופל במרכז מתמחה על ידי צוות רופאים ומטפלים מנוסים (אונקולוגים, מנתחים, רדיולוגים וכו'). כל מטופל מקבל טיפול מותאם אישית. הוא מורכב בעצם מכימותרפיה, הקרנות ו / או ניתוח.
כימותרפיה
במהלך הטיפול הכימותרפי, חולי סרטן העצמות מקבלים תרופות מיוחדות, מה שנקרא ציטוסטטיקה כגון מתוטרקסט, דוקסורוביצין או ציספלטין. אלה מעכבים את החלוקה והצמיחה של תאים שצומחים במהירות, כולל תאים סרטניים. זה מונע מהסרטן להתפשט הלאה.
ניתן לתת תרופות ציטוסטטיות כמזרקים, חליטות או טבליות. הם מפתחים את האפקט שלהם בכל הגוף, ולכן מדברים על טיפול מערכתי.
על מנת שהכימותרפיה תעבוד טוב יותר, חולי סרטן העצמות מקבלים בדרך כלל שילוב של מספר ציטוסטטיקה. אילו תרופות ציטוטוקסיות והמינון שניתן להם תלוי במקרה האינדיבידואלי (למשל בסוג והתפשטות גידול העצם הממאיר).
הציטוסטטיקה ניתנת במחזורים שנמשכים מספר ימים, בעיקר בבית החולים. בהפסקות הטיפול המתערבות, שיכולות להימשך בין ימים לשבועות, בדרך כלל מותר למטופלים לחזור הביתה. בסך הכל, כימותרפיה נמשכת מספר שבועות עד חודשים.
חולי סרטן עצם עם גידולים ממאירים במיוחד מקבלים כימותרפיה. צורות גידול פחות ממאירות כגון סוגים מסוימים של אוסטאוסרקומה או כונדרוסרקומה לא תמיד דורשות טיפול מערכתי זה.
לרוב נעשה כימותרפיה לפני הניתוח של הגידול. מה שמכונה כימותרפיה ניאו-אדג'ובנטית נועד לכווץ את הגידול כך שהניתוח שלאחר מכן יכול להיות עדין ובטוח יותר. בנוסף, הוא אמור להילחם בגרורות קיימות (מיקרו) ולמנוע את התפשטות הגידול (הלאה).
כחלופה או בנוסף לכך, כימותרפיה לאחר הניתוח (כימותרפיה אדג'ובנטית) יכולה להיות שימושית. במידת האפשר, הוא אמור להרוג כל תא גידול שנותר. המטרה היא שליטה ארוכת טווח בגידולים כך שהגידול לא יחזור או לא יחזור מהר.
במקרים מסוימים (כגון סרקומה של יואינג) כימותרפיה מתבצעת כטיפול אינדוקציה - כלומר כימותרפיה במינון גבוה בתחילת הטיפול בגידול. המטרה היא להרוג כמה שיותר תאים סרטניים במכה אחת.
כִּירוּרגִיָה
במהלך ההסרה הכירורגית של גידול העצם נחתכים כמה שיותר רקמות שצריך וכמה שפחות. חשוב גם להסיר רקמה בריאה מסביב לגידול או גרורות כדי לוודא שלא נותרו תאים סרטניים בקצה.
אם יש גידול עצם גדול מאוד בזרוע או ברגל, לפעמים יש לקטוע את כל הגפה. אולם, רוב הזמן פעולת "שמירה על הגפיים" מצליחה. אבל אז יש להחליף את רקמת העצם שהוסרה. זה קורה או עם החלפה מלאכותית ממתכת / פלסטיק (למשל החלפת מפרק מלאכותי) או עם עצם אחרת (למשל פיבולה כתחליף לחתיכת עצם עצם שהוסרה). ככלל, "עצם תחליף" זו מגיעה מהחולה עצמו, לעתים רחוקות יותר ממישהו אחר.
ניתוח פלסטי הפוך תופס עמדת ביניים בין קטיעה לניתוח שמירה על הגפיים: אם התפתח גידול עצם ממאיר בעצם הירך שמעל הברך, הרגל שמעל הגידול מוסרת. לאחר מכן מסובבים את הרגל התחתונה שהוסרה 180 מעלות ומקובעים לחלק הנותר של הירך באופן שכף הרגל מצביעה לאחור בגובה הברך השנייה. בדרך זו הקרסול העליון יכול להשתלט על תפקוד מפרק הברך שהוסר. לאחר מכן ניתן לחבר תותבת ברגל התחתונה.
הקרנות
בטיפול בהקרנות, קרניים בעלות אנרגיה גבוהה מופנות מבחוץ דרך העור לאזור הגידול. הם פוגעים בגנום של תאי הגידול, ואז הם מתים.
טיפול בקרינה הוא אופציה לסרטן העצמות אם:
- קשה להגיע לגידול ולכן לא ניתן לנתחו או לנתח רק באופן חלקי (למשל גידול בעצמות הגולגולת או הפנים או בעמוד השדרה).
- סרטן העצם הגיב בצורה גרועה לכימותרפיה.
צורת סרטן העצמות משחקת גם היא תפקיד: אוסטאוסרקומות וכונדרוסרקומות עמידות יחסית לקרינה, ולכן מטופלים מושפעים מקבלים לעתים רחוקות קרינה - בניגוד לחולים עם סרקומה של יואינג, מכיוון שהיא רגישה הרבה יותר לקרינה.
טיפול תומך
ככלל, טיפול בסרטן העצמות מניתוח, כימותרפיה ו / או טיפול קרינתי מתווסף על ידי טיפול תומך (טיפול תומך). המונח מתייחס לכל האמצעים להקלה ממוקדת בסימפטומים של סרטן העצם וכן לתופעות לוואי אפשריות של טיפול בסרטן העצם (למשל כימותרפיה). טיפול תומך נקרא גם טיפול מלווה או תומך.
להלן חלק מהתסמינים ותופעות הלוואי של סרטן המטופלים בטיפול תומך:
בחילה והקאה
כימותרפיה לסרטן העצמות גורמת לרוב לבחילות והקאות. סיכון זה קיים גם בטיפול בהקרנות (בהתאם למיקום וגודל אזור הגוף המוקרן ועוצמת ההקרנה).
לפני ובמהלך הטיפול הכימותרפי והקרנות, הרופא יכול לתת לכן תרופות למניעת בחילות והקאות. ניתן לתת את מה שנקרא אנטי-אלמטיקה כעירוי או בצורת טבליות.
דלקת של הממברנה הרירית (מוקוזיטיס)
הקרנות וכימותרפיה עלולות לגרום לדלקת ברירית הפה או לחלקים עמוקים יותר של מערכת העיכול. רירית הפה המודלקת הופכת לאדומה, כואבת ולעתים קרובות יש שלפוחיות או פצעים אחרים. דלקת הריריות העמוקות יותר במערכת העיכול יכולה לגרום להקאות ושלשולים.
טיפים נגד רירית הפה הדלקתית:
- המניעה הטובה ביותר היא היגיינת פה טובה ושטיפות פה קבועות עם מים או מי מלח.
- אין לאכול מזון חם, חריף או חומצי.
- במידת הצורך, הרופא ירשום משככי כאבים לכאבים הקשורים לדלקת בעת אכילה ושתייה.
חשוב שתבדוק באופן קבוע את רירית הפה שלך בעצמך ותדבר עם הרופא שלך מוקדם אם יש שינויים.
אם יש לך שלשול חמור כתוצאה מטיפול בסרטן העצמות, ייתכן שתקבל תרופות לטיפול בה. לפעמים יש צורך גם בחליטות כדי לפצות על אובדן האלקטרוליטים והנוזלים. במקרה של שלשול קל, לעתים קרובות מספיק לאכול בעדינות (למשל בלי אוכל חריף) ולשתות מספיק.
אם הריריות המותקפות נדבקו בחיידקים או בנגיפים, ייתכן שיהיה עליך ליטול אנטיביוטיקה או תרופות אנטי ויראליות.
אֲנֶמִיָה
גידול העצם עצמו, כמו גם כימותרפיה והקרנות, יכולים לגרום לאנמיה. סימנים לכך הם עייפות, תשישות מהירה, ביצועים ירודים, לחץ דם נמוך ועור חיוור. אם בדיקת דם מאשרת את החשד לאנמיה, הרופא עשוי לרשום תרופות המטופויטיות, אולי יחד עם תוסף ברזל. במקרים חמורים, ייתכן שיהיה צורך בעירוי דם.
חוסר בתאי דם לבנים
כימותרפיה מורידה את מספר תאי הדם הלבנים מסוימים הנקראים נויטרופילים. מה שנקרא נויטרופניה מקדם זיהומים עם חיידקים, פטריות או וירוסים. בנוסף, נויטרופניה יכולה להיות מלווה בחום (נויטרופניה חום), שעלולה לסכן חיים לחולי סרטן.
לכן, כאשר אתה מקבל כימותרפיה, הרופא שלך יפקח היטב על ספירת הדם שלך. כדי למנוע מחסור בכדוריות דם לבנות, הוא יכול לרשום גורמי גדילה של גרנולוציטים (G-CSF) או התפתחות נוספת שלהם (G-CSF pegylated). תרופות אלו מוזרקות מתחת לעור ומסייעות בבניית גרנולוציטים במח העצם.
יש לטפל בנויטרופניה פברית באנטיביוטיקה.
טיפ: כחולה סרטן, הקדיש תשומת לב מיוחדת להיגיינה טובה והתרחק מהמונים רבים וכן מאנשים הסובלים מחום או דלקת שפעת.
פגיעה באיברים ובעצבים
הציטוסטטיקה הניתנת לטיפול בסרטן העצמות יכולה לתקוף את הלב, הכליות, הכבד והעצבים. על מנת להצליח לזהות תופעות לוואי כאלה של כימותרפיה בשלב מוקדם, יש צורך בבדיקות קבועות במהלך הטיפול בסרטן (למשל בדיקות דם, בדיקות שמיעה, אולטרסאונד לב וכו ').
אם יש אינדיקציות לפגיעה באיברים או בעצבים, הכימותרפיה מותאמת בהתאם ו / או מתחיל טיפול ספציפי.
לדוגמה, אם קיים סיכון לפגיעה בכליות, חשוב לשתות מספיק. כהגנה נוספת על הכליות, הרופא יכול לרשום תרופות שהופכות את השתן לחומצי פחות (אלקליזציה בשתן).
אם סרטן העצמות שלך מטופל במינונים גבוהים של התרופה הציטוסטטית מתוטרקסט, בדרך כלל תקבל גם חומצה פולית. ויטמין B זה יכול למזער את הנזק לתאים בריאים כתוצאה מכימותרפיה.
אִי פּוּרִיוּת
כימותרפיה והקרנות עלולות לפגוע בשחלות ובאשכים. בנוסף, מרכז השליטה שלהם ברמה גבוהה יותר במוח - בלוטת יותרת המוח - יכול להיות מושפע. התוצאות הן הפרעות במחזור החודשי או הפרעה בהיווצרות הזרע. הפרעות אלה הן בדרך כלל זמניות בלבד, במקרים נדירים קבועות. אלה שנפגעים אז פוריים במידה מוגבלת או אפילו פוריים.
לכן עליך לחשוב על הסרת חלק מתאי הביצית או תאי הזרע שלך והקפאתם (קריו -שימור) לפני שתתחיל בטיפול בסרטן העצם. לאחר מכן תוכל להגשים אחר כך את רצונך להביא ילדים לעולם גם אם אינך פורייה.
לפני טיפול קרינתי מתוכנן לנערות / נשים באזור האגן, ייתכן שהשחלות יועברו בניתוח מחוץ לאזור הקרינה. לאחר מכן אינך נחשף לקרני אנרגיה גבוהה.
סרטן עצמות: טיפול להישנות ושלבים סופניים
לפעמים סרטן העצמות חוזר למרות טיפול אינטנסיבי מכיוון שתאי גידול בודדים שרדו כימותרפיה, ניתוחים ו / או הקרנות. הישנות זו של גידול נקראת הישנות. נבדלת בין:
- הישנות מקומית: הגידול החדש מתפתח באותו מקום כמו גידול העצם הראשון.
- הישנות רחוקה: הגידול החדש גדל במקומות אחרים בגוף. הישנות רחוקה כל כך שכיחה יותר מהישנות מקומית.
יש להסיר את מוקדי הסרטן החדשים לחלוטין בניתוח. אם זה לא אפשרי, קרינה יכולה להיות שימושית גם - במיוחד עם סרקומה של יואינג. בדרך כלל יש צורך שוב בכימותרפיה נוספת.
סרטן עצם בשלב סופי: טיפול פליאטיבי
אם סרטן העצמות מתקדם מאוד או במקום בלתי נגיש, לרוב לא ניתן לרפא אותו. במצב זה, הרופאים יכולים לפחות להקל על הסימפטומים הנלווים לסרטן.
מה שנקרא טיפול פליאטיבי לסרטן העצמות כולל בעיקר מתן משככי כאבים. ניתן גם לבצע טיפול קרינתי בכדי לכווץ את הגידול ולהפחית כאבים. ניתן לנסות כימותרפיה גם במסגרת לימודים.
סרטן עצמות: שיקום
לאחר הטיפול בסרטן, המטופלים צריכים קודם כל למצוא את הדרך חזרה לחיי היומיום ולחיים החברתיים, הלימודיים או המקצועיים שלהם. תוכניות שיקום עוזרות בכך.
שם תלמדו למשל כיצד להתמודד עם כאבי פאנטום (לאחר קטיעה) או כיצד להתמודד עם תותבת או פלסטיק היפוך. תוכניות פיזיותרפיה וספורט יכולות לסייע לך בכך, למשל. הם גם שימושיים למניעת מגבלות תפקודיות הנגרמות על ידי שרירים מצולקים.
הרופאים מתמודדים גם עם השלכות אחרות של ניתוח כמו הפרעות בריפוי פצעים או זיהומים כרוניים.
אורח חיים בריא תורם גם לאיכות חיים טובה - במיוחד לאחר מחלה קשה כמו סרטן עצם. כחלק מהשיקום, אתה מניע את המומחים לאכול תזונה מאוזנת ולהתאמן מספיק. כמו כן, עליך לדאוג לשניהם לאחר השיקום.
אחרון חביב, שהייה במרפאת שיקום נותנת לך את ההזדמנות להכיר אנשים הסובלים אחרים ולשתף אותם בחוויותיך ובחששותיך.
סרטן העצמות: טיפול המשך
טיפול בסרטן הוא נטל עצום על הגוף. תאים ואיברים בריאים יכולים לסבול מתופעות הלוואי לאורך זמן. בעיות הנמשכות עד חמש שנים לאחר הטיפול נקראות השלכות ארוכות טווח. בעיות בריאות המופיעות מספר שנים לאחר הטיפול הן מה שמכונה השפעות ארוכות טווח של טיפול בסרטן.
הם כוללים גם את הסיכון לחזרה של הגידול או התפתחות סרטן חדש כתוצאה מהטיפול (ראה להלן). לכן יש צורך בבדיקות סדירות. אתה בהחלט צריך להשתתף בפגישות ההמשך האלה לכל החיים! הרופא שלך יגיד לך באיזה מרווחים הבדיקות האלה הגיוניות במקרה שלך ואילו בדיקות הן כוללות.
טיפול מעקב אחר סרטן הוא גם מניעת מחלות. ככל שמבחינים בהשלכות אפשריות מאוחרות יותר של סרטן, כך ניתן לטפל בה טוב יותר.
להלן מספר נקודות חשובות שיש לקחת בחשבון בטיפול המשך בסרטן העצם (או טיפול במעקב סרטן באופן כללי):
סרטן שני וחזרה
כימותרפיה והקרנות נלחמות בסרטן העצמות, אך בה בעת מגבירות את הסיכון לסוגי סרטן משניים אחרים כגון סרטן הדם (לוקמיה). בנוסף, הגידול המקורי יכול לחזור על עצמו כחזרה או בצורה של גרורות בריאות או בשלד.
לכן הרופאים בוחנים אותך באופן קבוע לאיתור מוקדי גידול במסגרת הטיפול שלך, למשל באמצעות בדיקות דם ושיטות הדמיה כגון אולטרסאונד, טומוגרפיה ממוחשבת, טומוגרפיה של תהודה מגנטית או סקינטגרפיה.
פוריות
מאחר וטיפול כימותרפי והקרנות עלולים לפגוע בשחלות, באשכים ובבלוטת יותרת המוח (כנקודת בקרה על), הרופאים עוקבים אחר התפתחות ההתבגרות אצל בנים ובנות לאחר טיפול בסרטן.
עוד לפני הטיפול, הם בודקים את נפח האשך של גברים מתבגרים ומודדים את ריכוז הורמוני המין בדם. זה מקל על זיהוי הפרעות כתוצאה מטיפולים בסרטן מאוחר יותר. כחלק מטיפול המעקב הרופאים מסתכלים על השפיכה מתחת למיקרוסקופ ויוצרים מה שנקרא זרע.
נשים מתבגרות צריכות לרשום את דימום הווסת שלהן בלוח המחזור החודשי ולהראות אותן בפני רופא הנשים במהלך טיפול מעקב. בנוסף, רופא הנשים יכול לקבוע את הורמוני המין ולנטרל הפרעות בעזרת תרופות.
תפקוד הלב
הדוקסורוביצין הכימותרפי (ציטוסטטי) בפרט יכול לתקוף את תאי שריר הלב. טיפול קרינה יכול גם לפגוע בלב. הפרעות בתפקוד הלב עלולות להתפתח במהלך הטיפול בסרטן, אך גם שנים לאחר מכן. ניתן לאתר אותם מוקדם עם בדיקות לב סדירות - אלקטרוקרדיוגרפיה (EKG) ואולטרסאונד לב (אקו לב).
תפקוד כליות
תרופות כימותרפיות כגון ציספלטין או מתוטרקסט עלולות לפגוע בכליות. על הרופאים לבדוק את תפקוד הכליות לאחר כימותרפיה באמצעות דגימות דם ושתן לפחות פעם בשנה. אם אין סימנים לפגיעה בתפקוד הכליות במשך מספר שנים, ניתן להשמיט את הפקדים.
שמיעה
פלטינה, הכלולה בתרופה הציסטוסטטית ציספלטין, תוקפת את תאי השיער באוזן הפנימית. כתוצאה מכך, חלק מחולי הסרטן אינם יכולים לשמוע יותר צלילים גבוהים (אובדן שמיעה גבוה) או לפתח רעשים זמניים או ארוכי טווח באוזניים (טינטון).
בדיוק כמו כימותרפיה, קרינה באזור הראש עלולה לפגוע בשמיעה.
ניתן לזהות הפרעות שמיעה כאלה במהירות באמצעות בדיקות שמיעה. הדבר חשוב במיוחד לילדים ומתבגרים, כך שיוכלו לקבל מכשיר שמיעה מוקדם במידת הצורך (חשוב להתפתחות תקינה!).
ריאה
קרינה באזור החזה (למשל במקרה של גרורות ריאה) יכולה להוביל לדלקת ריאות. זה יכול להשאיר הצטלקות ברקמת הריאה כשהיא מתרפאת, מה שעלול להגביל את תפקוד הריאות. אלה שנפגעים אז פחות מסוגלים לעשות ספורט, למשל. פעילות גופנית יכולה לשפר את תפקוד הריאות.
עישון יכול גם להגביל את תפקוד הריאות. אז תעשי בלי זה.
בעיות אורטופדיות
סרטן עצמות אצל ילדים יכול להשפיע על הצמיחה. לדוגמה, ריבוי וטיפול בגידול עצם ברגל אחת יכולים לגרום לאורכים שונים של הרגליים. על ידי ביצוע מדידות אורך קבועות כחלק מבדיקות המעקב, הרופא יכול לראות בשלב מוקדם האם אחת מרגליים של הילד קצרה יותר מהשנייה. ניתן לאזן את ההבדל הזה באופן אורתופדי, למשל עם מדרסי נעליים. זה הכרחי כדי להימנע מיציבה רעה ועומס מפרקים בשל אורכי הרגליים השונים.
בעיות אורתופדיות יכולות לנבוע גם מהתותבת ששימשה במהלך הניתוח הסרטן. לדוגמה, אם אתה, כחובש רגליים תותבות, חווה כאב או תחושת חוסר יציבות בזמן הליכה, עליך להתייעץ עם הרופא שלך. אז יתכן ויתפוג פיר התותב, שבעזרתו התותבת מעוגנת בעצם. לאחר מכן יש להחליפו.
בנוסף, התותבת עלולה להידלק, למשל על ידי פתוגנים בדם לאחר הניתוח. פירסינג ועישון גם מעלים את הסיכון לזיהום. אם האזור שמסביב לתותבת מאדים, מתנפח, מרגיש שנקרא או כואב, עליך לפנות מיד לרופא!
הודע לרופא או לרופא השיניים שלך על שיניים תותבות אם מתוכנן ניתוח. אז זה יכול למנוע הידבקות באנטיביוטיקה.
הגנה על חיסון לאחר סרטן
עליך לבדוק את החיסון חודשיים עד שלושה חודשים לאחר סיום הטיפול בסרטן העצמות. כיוון שכימותרפיה יכולה לגרום לכך שהגנת החיסון הקודמת כנגד מחלות שונות אבדה.
השפעות פסיכו-סוציאליות לטווח ארוך
בפגישות המעקב, הרופא שלך לא מתעניין רק באיך שאתה מבחינה פיזית. הוא גם ירצה לקבוע אם אתה זקוק לעזרה בהתמודדות עם הסרטן או בהתמודדות עם חייך באופן כללי. מכיוון שלסרטן ולטיפול בסרטן יכולות להיות השלכות פסיכו-חברתיות ארוכות טווח.
לדוגמה, קטיעות ופרוטזות משנות את דימוי הגוף, דבר שיכול להשפיע לרעה על הביטחון העצמי של אלה שנפגעו. הפרעות שינה, דיכאון, פחד מייסר להישנות ותסמונת העייפות כביכול הן גם השלכות ארוכות טווח של סרטן העצם והטיפול בו.
אחרון חביב, הסביבה החברתית יכולה להשתנות. לפעמים שותפויות וחברויות מתפרקות, שינוי בעבודה עשוי להיות נחוץ או ביצועי בית הספר עלולים לרדת. גם המצב הכלכלי של חולי סרטן יכול להידרדר.
הרופא שלך יכול ליצור איתך קשר עם איש הקשר הנכון בכל המקרים. חשוב שתדבר על זה ותקבל את התמיכה.
סרטן עצמות: סיבות
מדוע גידולי עצם מתפתחים עדיין לא מובנים במלואם. עם זאת, חוקרים חושדים שיש קשר סיבתי בין צמיחת עצם מהירה בילדות ובגיל ההתבגרות לבין אוסטאוסרקומה. הסיבה לכך היא שהעצמות גדלות במהירות במיוחד בגיל ההתבגרות - ובדיוק בשלב זה אוסטאוסרקומה מתרחשת לעתים קרובות. זה גם יסביר מדוע בנים נוטים יותר להיפגע. כי איתם נוצר נפח עצם גדול יותר על פני תקופה ארוכה יותר מאשר אצל בנות.
בנוסף, סביר להניח כי שינויים גנטיים ממלאים תפקיד מרכזי. לפחות לילדים ולמתבגרים עם מחלות תורשתיות מסוימות יש סיכון מוגבר לאוסטיאוסרקומה: אלה כוללים רטינובלסטומה דו-צדדית ותסמונת Li-Fraumeni.
בנוסף, הסיכון לאוסטאוסרקומה עולה אם קיימות מחלות עצם כרוניות מסוימות, כגון מחלת פאג'ט.
בנוסף, גורמים סביבתיים יכולים לאלץ היווצרות אוסטאוסרקומה. אוסטאוסרקומה יכולה להופיע ארבע עד 40 שנים לאחר טיפול בהקרנות. זה נקרא אוסטאוסרקומה משנית מכיוון שזה נגרם על ידי טיפול בסרטן ראשוני. כימותרפיה יכולה גם לפגוע בתאים היוצרים עצמות בצורה כזו שתהיה סבירות גבוהה יותר להיווצרות אוסטאוסרקומה משנית.
עם זאת, ב -90 אחוז מהמקרים אף אחד מגורמי הסיכון שהוזכרו לא נמצא עבור הגרסה האוסטאוסרקומה של סרטן העצם.
סרטן העצמות: מידע נוסף
סיוע לסרטן הגרמני: https://www.krebshilfe.de
מרכז המידע הגרמני לסרטן: https://www.krebsinformationsdienst.de
יתום - הפורטל למחלות נדירות ותרופות יתומות: https://www.orpha.net
COSS (קבוצת מחקר OsteoSarcoma Cooperative): http://olgahospital-stuttgart.de/index.php?id=1022/
Kinderkrebsinfo.de - פורטל מידע על סרטן ומחלות דם בילדים ומתבגרים: https://www.kinderkrebsinfo.de
מרכז בינתחומי לגידולים של עצמות ורקמות רכות, מרפאת LMU של אוניברסיטת מינכן - קמפוס גרוסהאדרן
ZSE ברלין: מרפאת חוץ מיוחדת לאונקולוגיה ילדים (מוסמכת DKG e.V.), Charité - Universitätsmedizin Berlin (CVK)
מרפאה לאורתופדיה כללית ואורתופדיה לגידול בבית החולים האוניברסיטאי מינסטר (אחד המרכזים הגדולים בעולם לטיפול בחולי סרטן עצם): https://internationalpatients.ukmuenster.de/index.php?id=bone-and-soft -רקמה-סרקומות & L = 0
מערכת מעקב אחר אפקטים מאוחרים (LESS): www.nachsorge-ist-vorsorge.de
none: רפואה פליאטיבית בריאות דיגיטלית דִיאֵטָה.jpg)






-der-giraffentrick.jpg)